- ES
- EN

Un sitio web oficial de la Organización de Innovación Biotecnológica

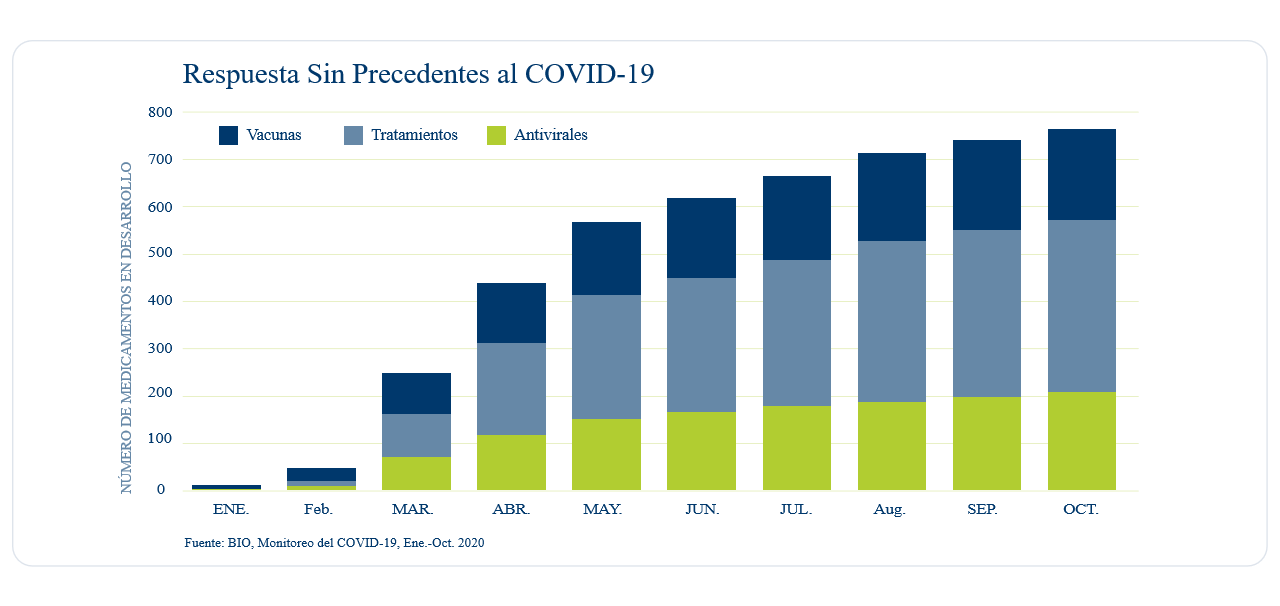
Los investigadores se están moviendo rápidamente para desarrollar vacunas para combatir el Covid-19. Anteriormente, se necesitaban años para lograr que una nueva vacuna superara todos los requerimientos reglamentarios establecidos por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA por sus siglas en ingles) y para su aprobación.
Sin embargo, actualmente y a menos de un año desde que el primer caso de Covid-19 fuera diagnosticado en los Estados Unidos, hay aproximadamente 200 potenciales vacunas en proceso, algunas de las cuales se encuentran en las etapas finales de desarrollo clínico. ¿Cómo es esto posible?
A continuación, explicamos tres factores importantes que han permitido que los investigadores biofarmacéuticos logren avanzar rápidamente en la carrera por encontrar una vacuna contra el Covid-19:
Tecnologías novedosas
Durante las últimas décadas, se han llevado a cabo importantes mejoras científicas que han permitido acortar el tiempo necesario para una investigación básica. Esto incluye una nueva tecnología que permitió a los investigadores mapear el código genético del coronavirus en solo unos pocos meses.
Además, los científicos no empezaron "desde cero" en su búsqueda de la vacuna contra el Covid-19. Si bien el Covid-19 es un virus nuevo, los virus del tipo coronavirus no son enfermedades nuevas. En la búsqueda de vacunas contra otros tipos de coronavirus como lo son el MERS y el SARS, los desarrolladores de vacunas han estado investigando por años la microbiología y química básicas de estos diferentes virus.
Con este conocimiento, los investigadores han podido identificar candidatos a vacunas prometedoras más rápido que nunca. La innovación en diferentes plataformas o enfoques para el desarrollo de vacunas, como las vacunas de vectores virales, ARNm y ADN, y los sistemas de expresión de proteínas, se han probado y mejorado durante muchos años para permitirnos avanzar más rápidamente hoy en día.

¿Abrumado? Estos son términos complejos que la mayoría de la gente nunca ha escuchado antes. Afortunadamente, el The New York Times publicó una guía útil para los diferentes enfoques científicos que los investigadores están adoptando para encontrar una vacuna contra el Covid-19, incluyendo los mencionados anteriormente.
Una importante conclusión: Todas estas plataformas diferentes permiten a los investigadores atacar más rápidamente los virus a medida que surgen, agilizando así el proceso de investigación y desarrollo, y asegurando que tengamos múltiples soluciones para abordar las diversas necesidades de la población a nivel mundial.

O, dicho de otra manera, es como un constructor de viviendas que planea construir una casa nueva, y resulta que los cimientos ya están construidos – lo que le permitirá al constructor ahorrar un tiempo importante en el proceso de construcción.
Colaboración
En los últimos meses, ha habido una importante colaboración entre el sector público y privado con un mismo objetivo: acabar con la pandemia del Covid-19 de forma rápida y segura. Esta cooperación mundial sin precedentes ha ayudado a acelerar el proceso de investigación y desarrollo.
Como explicamos en "¿Cómo se desarrollan las vacunas?," el protocolo del ensayo clínico describe importantes decisiones de investigación, sea cómo se probará la vacuna y cómo se definirá su éxito. Con casi 200 vacunas experimentales contra el Covid-19 en proceso, la FDA y los Institutos Nacionales de Salud (NIH) desarrollaron un criterio base para que sea utilizado por todos los fabricantes de vacunas. La guía ha hecho que sea más eficiente para la FDA comparar datos y resultados entre diversas vacunas, y ha permitido a los desarrolladores de vacunas contra el Covid-19 a que trabajen en base a un manual estándar para lograr el mismo objetivo de desacelerar la propagación del Covid-19. Es como si fuera un manual común que todos los participantes deben seguir para mantenerse en juego.
Ejemplo B: Infraestructura del sitio de ensayos clínicos
Los ensayos clínicos requieren de miles de participantes de diferentes antecedentes raciales, niveles de salud y edades. Sin una muestra grande y diversa, es difícil para que los investigadores determinen si una vacuna es segura y eficaz para personas de todas las familias y comunidades.
Siempre es un desafío el poder encontrar el número correcto de participantes a ensayos clínicos – especialmente cuando hay más de 200 vacunas en preparación contra una sola enfermedad. Para ahorrar tiempo, las empresas de investigación biofarmacéutica y el NIH hicieron uso de una red ya existente de sitios de ensayos clínicos y un sitio web de reclutamiento central para acelerar el registro de voluntarios para ensayos clínicos y el inicio de la investigación clínica.
Ejemplo C: Fabricación
Probar la seguridad y eficacia de una vacuna es tan solo una pieza del rompecabezas. Para proveer de una solución a la pandemia, también necesitamos producir un suministro de vacunas de manera segura, eficiente y constante. Las empresas de investigación biofarmacéutica, las agencias gubernamentales y los socios no gubernamentales están trabajando activamente juntos – y lo han hecho durante meses – para incrementar proporcionalmente el proceso de fabricación y comenzar a producir vacunas a medida que se realizan los ensayos clínicos. Esto permitirá que las dosis comiencen a administrarse inmediatamente después de que se autorice el uso de una vacuna. En última instancia, estos esfuerzos ayudarán a garantizar un proceso de distribución de vacunas de una manera más eficiente para poder proveer rápidamente las dosis a las personas y comunidades que las necesitan.
Priorizando recursos
Las empresas de investigación biofarmacéutica generalmente suelen trabajar en varios productos a la vez y así poder desarrollar mejores tratamientos para una variedad de enfermedades – desde el cáncer hasta el Alzheimer, la diabetes, la depresión y más.
Sin embargo, desde el inicio de la pandemia, los investigadores han destinado importantes recursos y tiempo a encontrar una vacuna segura y eficaz contra el Covid-19. Si bien esto puede afectar otras investigaciones importantes, es una razón más por la que quienes desarrollan una vacuna se han movido tan rápidamente.
Los gobiernos alrededor del mundo y aquí en los Estados Unidos también se han destinado recursos a la lucha contra el Covid-19. La FDA, por ejemplo, ha tomado algunas decisiones estratégicas para priorizar su tiempo, supervisión y trámites relacionados con las vacunas contra el Covid-19. La FDA ha instituido un proceso de "revisión continua" para permitir que los expertos independientes de la agencia de gobierno analicen los datos de investigación en tiempo real. Esto significa que todos están siguiendo los mismos pasos regulatorios necesarios para el desarrollo de medicamentos, pero con recursos dedicados para avanzar con mayor rapidez.
Todos estos factores – colaboración, innovación y priorización – acelerarán el desarrollo, la aprobación y la distribución de una vacuna contra el Covid-19 sin poner en peligro las salvaguardias críticas de seguridad y eficacia.
1201 Maryland Avenue SW, Suite 900, Washington, DC, 20024 ● 202-962-9200
® BIO 2020 Todos los derechos reservados