- ES
- EN

Un sitio web oficial de la Organización de Innovación Biotecnológica
Con el desarrollo de vacunas avanzando tan rápidamente, es fácil entender por qué algunas personas se preguntan si una vacuna contra el Covid-19 será segura y efectiva. Es importante recordar el estricto proceso científico y normativo que los desarrolladores de vacunas deben seguir para llevar un nuevo producto a los pacientes, incluso durante la pandemia por la que atravesamos actualmente. Los expertos independientes de la Administración de Drogas y Alimentos de los Estados Unidos (FDA por sus siglas en inglés) no aprobarán una vacuna a menos que haya datos que demuestren que ésta sea:
- Segura de usar después de una serie de ensayos clínicos aleatorios basados en placebo de miles de personas;
- Haya demostrado ser eficaz para prevenir la enfermedad; y,
- Demuestre la capacidad de ser producida o fabricada de manera consistente, segura y de alta calidad.
Visite “¿Cómo se desarrollan las vacunas?” para más información sobre cómo funciona el proceso de desarrollo de vacunas.
Además de las propias reglas y garantías rigurosas de la FDA, existen otros niveles de supervisión para garantizar que haya un enfoque constante en la seguridad del paciente en cada paso del proceso de desarrollo, aprobación y distribución.
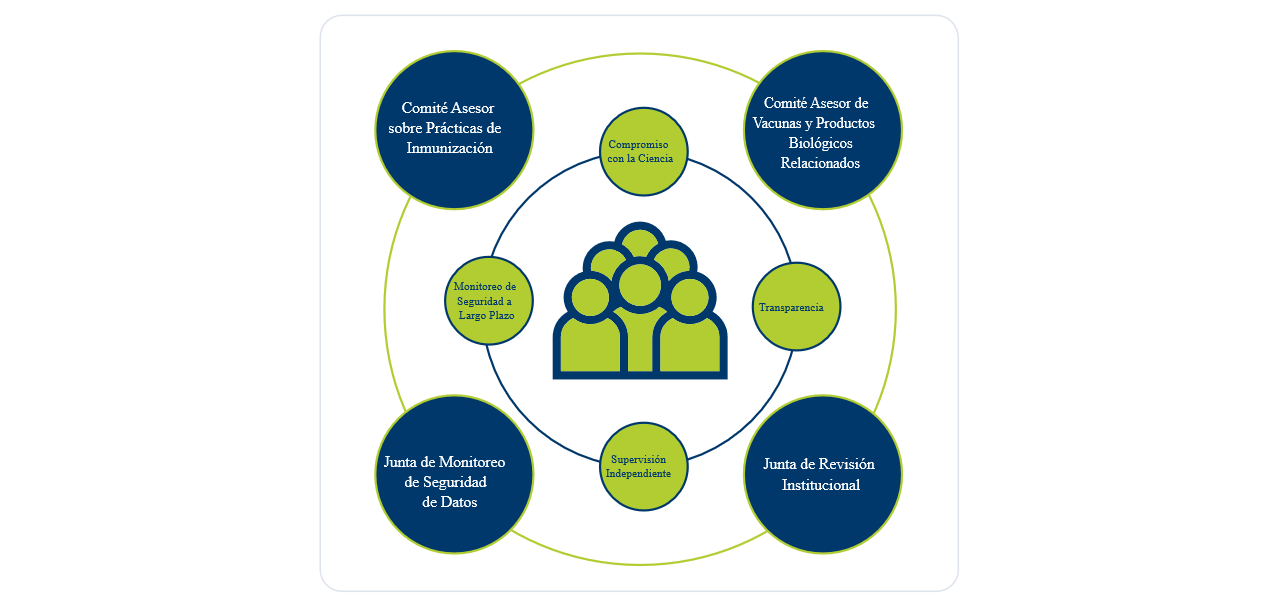
Supervisión independiente
Existen múltiples niveles de supervisión independiente como parte del proceso de desarrollo de vacunas existente, los mismos que hoy juegan un rol fundamental en la rápida respuesta a la pandemia del Covid-19.
- Los Consejos de Revisión Institucional están compuestos por expertos científicos y de la salud. Según la FDA, el propósito de los Consejos es el de "asegurar, tanto por adelantado como mediante revisiones periódicas, que se tomen las medidas adecuadas para proteger los derechos y el bienestar" de las personas inscritas en los ensayos clínicos. Los Consejos tienen la autoridad de aprobar o desaprobar un estudio clínico – o requerir cambios en la investigación. Las decisiones de los Consejos se basan únicamente en lo que es mejor para los participantes de los ensayos clínicos.
- Las Juntas de Monitoreo de Seguridad de Datos son grupos independientes de expertos que incluyen biólogos, inmunólogos, estadísticos y profesionales de la salud. Analizan datos en tiempo real durante el proceso del ensayo clínico, ofreciendo asesoramiento y experiencia sobre si un ensayo debe avanzar y cómo debe avanzar o si debe detenerse. Estos expertos brindan una evaluación imparcial para asegurarse de que se sigan las reglas de seguridad y eficacia y que se aborde cualquier inquietud que pudiera surgir a lo largo del proceso.
- El Comité Asesor de Vacunas y Productos Biológicos Relacionados es un grupo que forma parte de la FDA compuesto por 15 miembros votantes independientes que tienen conocimientos en campos variados, tales como inmunología, biología molecular, virología, bacteriología, epidemiología, políticas públicas relacionadas con vacunas, ciencia de seguridad de vacunas, desarrollo de vacunas, medicina y enfermedades infecciosas, y además ofrece un representante que opera a favor del consumidor. Tras finalizar un ensayo clínico, este Comité Asesor revisa los datos de la vacuna específica y provee de una recomendación a la FDA sobre si el producto debiera ser aprobado o autorizado bajo licencia para su uso.
- El Comité Asesor sobre Prácticas de Inmunización (ACIP por sus siglas en inglés) es un grupo de expertos médicos y de la salud pública independientes que asesoran a los Centros para el Control y la Prevención de Enfermedades (CDC). El Comité revisa los datos de seguridad y eficacia para los ensayos clínicos en tiempo real. Tras la aprobación de una vacuna por parte de la FDA, el Comité implementa una revisión final de los datos de seguridad y eficacia de la vacuna para hacer recomendaciones sobre quién debe recibir una vacuna y cuándo. Se consideran aspectos tales como la edad, las condiciones de salud subyacentes y otros factores de riesgo para determinar el mejor uso público de la vacuna. Visite "¿Cuándo recibiremos mi familia y yo la vacuna contra el Covid-19?" para más información sobre el rol fundamental de salud pública que ejerce el ACIP.
Confianza a través de la transparencia
La transparencia es una de las formas más importantes de informar al público – y generar una mayor confianza – en el proceso para desarrollar la vacuna contra el Covid-19. Las agencias gubernamentales, tales como la FDA y la CDC, han estado regularmente publicando información relevante y han organizado reuniones abiertas al público para permitir retroalimentación y así lograr una toma de decisiones informada.
Por ejemplo, la FDA publicó una guía que establece lo que espera ver en los datos de seguridad y eficacia antes de aprobar una vacuna contra el Covid-19. La FDA también publicó una guía la cual explica lo que los investigadores deberán mostrar para recibir la autorización de uso de emergencia (se incluye una explicación más detallada líneas a continuación) de sus vacunas. La publicación de ambos documentos de orientación hacia el público brindó información relevante sobre la toma de decisiones de la FDA, su compromiso a ser una organización transparente y cómo los investigadores están trabajando para desarrollar una vacuna.
Las empresas de investigación biofarmacéutica también han tomado medidas para brindar una mayor transparencia al proceso de desarrollo de la vacuna contra el Covid-19. Por ejemplo, no es raro que se produzca una pausa en los ensayos clínicos, pero rara vez se informan públicamente. Sin embargo, la decisión de varias empresas de revelar que habían detenido los ensayos clínicos después de que surgieron preguntas de seguridad ha ayudado a mantener informado al público sobre cualquier obstáculo en el desarrollo de una vacuna.
Un compromiso con la ciencia y la seguridad
Si bien existe una necesidad urgente de encontrar una vacuna contra el Covid-19, las empresas de investigación biofarmacéutica han anunciado públicamente su firme compromiso de dejar que la ciencia guíe el desarrollo de una vacuna.
En septiembre de 2020, ejecutivos de nueve empresas biofarmacéuticas publicaron una declaración conjunta en la cual afirman que "se adherirán a altos estándares científicos y éticos" y que solo presentarán una vacuna para su aprobación "después de haber demostrado su seguridad y su eficacia" a través de un estudio clínico de fase 3 que cumple con los estrictos requisitos de la FDA.
Otros ejecutivos en la industria biotecnológica publicaron una carta abierta instando a todos los que trabajan contra el Covid-19 a garantizar la "integridad, transparencia y evaluación objetiva" de los datos clínicos con la finalidad de promover la confianza del público en cualquier tratamiento destinado a afrontar la pandemia.
Seguridad es la prioridad, incluyendo en casos de emergencia
Se han dado muchos debates sobre si la FDA debería hacer uso de su autoridad para otorgar lo que se conoce como “autorización de uso de emergencia” para una vacuna contra el Covid-19, y qué podría significar esto para la seguridad del paciente. La FDA ha otorgado este tipo de autorizaciones en el pasado, pero por lo general aprueba una vacuna a través de una Autorización de Licencia Biológica, la cual requiere de años de datos clínicos para lo que se considera una aprobación completa de la FDA.

Tras múltiples amenazas ante la salud pública, la FDA recibió la autoridad legal para permitir el “uso de emergencia” de productos médicos que no habían recibido la aprobación completa de la FDA en el año 2004. La idea era que, durante una crisis de salud pública como la actual pandemia por la que estamos atravesando, los beneficios para las familias y las comunidades superaban los riesgos de permitir el uso de un producto médico antes de que fuera aprobado.
Durante una emergencia de salud pública, la FDA establece aún un estándar significativamente alto para el uso de emergencia de cualquier vacuna, y esto aplica en el caso de la actual pandemia. Además, cualquier uso de emergencia se limita a aquellos con mayor riesgo de infección o enfermedad grave. Esto garantiza que se priorice la protección de las poblaciones más vulnerables – tales como los ancianos y los trabajadores de atención médica de primera línea – mientras se continúan recopilando datos para su uso público más amplio.
Para más información sobre cómo funciona el uso de emergencia y lo que significa para los pacientes, vea este breve video informativo con los expertos de la FDA.

Monitoreo de seguridad a largo plazo
Incluso después de aprobarse una vacuna contra el Covid-19, la FDA, la CDC, los sistemas de salud y los desarrolladores de vacunas seguirán monitoreando la seguridad y eficacia de la vacuna durante años. Las vacunas contra el Covid-19 estarán sujetas a los mismos requisitos de seguridad a largo plazo y aplicarán los mismos sistemas de monitoreo de seguridad que las vacunas de rutina. Mientras tanto, la CDC y la FDA están creando un nuevo sistema de monitoreo, VSAFE, que permitirá a las personas enviar cualquier problema de seguridad por mensaje de texto.
Los proveedores de atención médica representan un nivel adicional de protección a nivel estatal y local. Esto incluye a personas como su médico, farmacéuticos y departamentos de salud estatales. Estos profesionales de la salud deben informar cualquier efecto adverso – por raro que sea – a la FDA y a la CDC.
Los varios niveles de los sistemas de seguridad de la FDA, junto con los desarrolladores de vacunas y los proveedores de atención médica locales, garantizan que nadie podrá tomar atajos cuando se trata de la seguridad del paciente.
1201 Maryland Avenue SW, Suite 900, Washington, DC, 20024 ● 202-962-9200
® BIO 2020 Todos los derechos reservados